02.11.2011 tarihli ve 28103 sayılı Resmi Gazetede yayımlanan “Sağlık Bakanlığı ve Bağlı Kuruluşlarının Teşkilat ve Görevleri Hakkında Kanun Hükmünde Kararname” kapsamında Türkiye’de ilaçların ruhsatlandırılması, üretimi, depolanması, satışı, ithalatı, ihracatı, piyasaya arzı, dağıtımı, hizmete sunulması, toplatılması ve kullanımları ile ilgili kural ve standartları belirlemek, bu faaliyetleri yürütecek kamu ve özel hukuk tüzel kişileri ile gerçek kişilere izin vermek, ruhsatlandırmak, denetlemek ve gerektiğinde yaptırım uygulamak, laboratuvar analizlerini yapmak veya yaptırmak üzere yetkili makam “Türkiye İlaç ve Tıbbi Cihaz Kurumu”dur.
TİTCK tarafından ruhsatlandırılmayan hiçbir beşeri tıbbi ürün pazara sunulamaz ve Türkiye sınırları dahilinde yerleşik bulunan gerçek veya tüzel kişiler, bir ürünü pazara sunmak amacıyla ruhsat alabilmek için Beşeri Tıbbi Ürünler Ruhsatlandırma Yönetmeliğinin Ek-1’inde belirtilen tıbbi ürün ruhsat başvurusunda sunulması gereken bilgi ve belgeleri, her bir farmasötik form için hazırlayarak Bakanlığa sunmak zorundadır.
Ruhsat başvuru dosyalarının hazırlanmasında, Ortak Teknik Doküman (Common Technical Document, CTD) kılavuzunun takip edilmesi gerekmektedir. CTD, üç ICH (International Conference on Harmonisation) bölgesi olan Avrupa, ABD ve Japonya’daki ilaç ruhsatlandırma makamlarına yapılacak başvuruların planlı şekilde sunulmasını hedefleyen ve uluslararası alanda üzerinde uzlaşmaya varılan bir formattır.
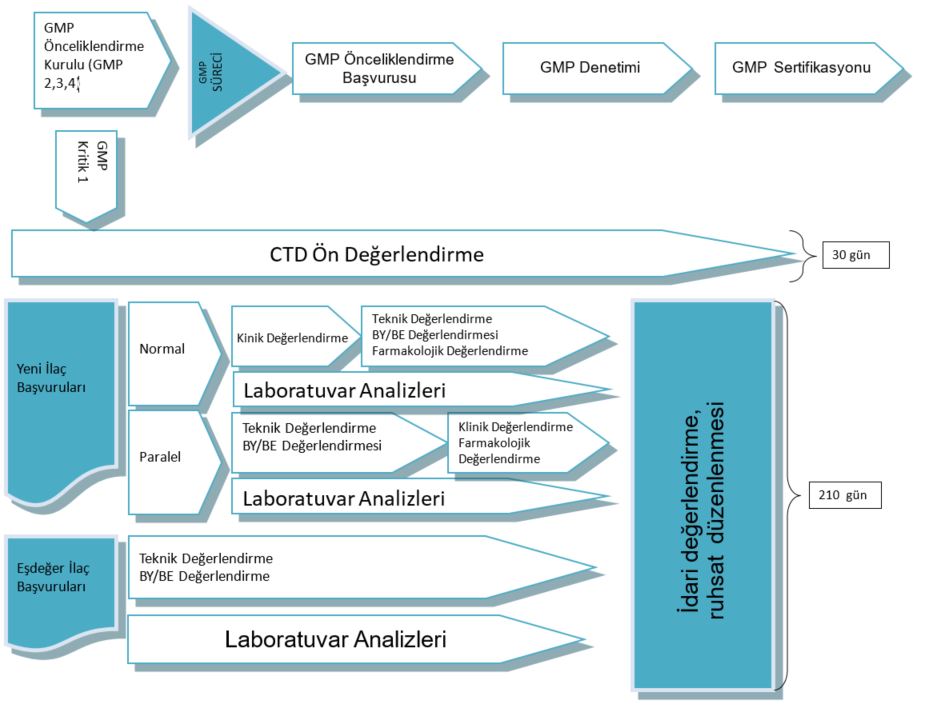
İlaç Ruhsat alım ve İlaç Varyasyon Başvuru Prosedürü
İlaç ruhsat alımı ( Geleneksel Bitkisel Tıbbi Ürünler, Reçeteli/reçetesiz İlaç,CTD başvuru ve dosya takibi )
İlaç varyasyon başvuruları ve takibi
KÜB/KT başvuruları ve takibi
GMP başvurusu, takibi ve denetim organizasyonu,
İlaç fiyat başvurusu ve takibi
Satış izni alımı,
Ruhsat devri
Ruhsat yenileme
İthalat izin belgesi alımı,
İthalat geri bildirimlerin yapılması,
İlaç tanıtım başvurusu yapılması
Bedelsiz numune izni alınması
Zayi ruhsat başvurusu
İthalden, imale geçiş başvurusu
CPP başvurusu ve takibi
Serbest satış sertifikası (FSC) alımı
SGK başvuru dosyası takibi
Ek-4 A listesinde pasiflenen ürünün aktiflenmesi
